W artykule omówimy, jak zrozumieć podstawy konfiguracji elektronowej, a także jak zidentyfikować blok pierwiastka oraz obliczyć liczbę elektronów walencyjnych. Przedstawimy również konkretne przykłady, takie jak lit, neon i glin, aby pokazać, jak te zasady są stosowane w praktyce. Dzięki temu każdy będzie mógł łatwo określić nazwę i symbol pierwiastka chemicznego na podstawie jego konfiguracji elektronowej.
Kluczowe wnioski:
- Konfiguracja elektronowa jest kluczowa do identyfikacji pierwiastków chemicznych.
- Każdy pierwiastek należy do określonego bloku w układzie okresowym, co można ustalić na podstawie jego konfiguracji.
- Powłoki elektronowe i elektrony walencyjne mają istotny wpływ na właściwości chemiczne pierwiastków.
- Lit (Li) ma 1 elektron walencyjny i należy do bloku s.
- Neon (Ne) ma 8 elektronów walencyjnych i należy do bloku p.
- Glin (Al) ma 3 elektrony walencyjne i również należy do bloku p.
Jak określić nazwę i symbol pierwiastka chemicznego z konfiguracji elektronowej
Określenie nazwy i symbolu pierwiastka chemicznego na podstawie jego konfiguracji elektronowej jest kluczowe w chemii. Konfiguracja elektronowa przedstawia sposób, w jaki elektrony są rozmieszczone wokół jądra atomowego. Dzięki tej wiedzy możemy zrozumieć, jakie właściwości chemiczne ma dany pierwiastek i w jakim miejscu znajduje się w układzie okresowym. To z kolei pozwala na łatwiejsze identyfikowanie pierwiastków i ich zastosowań w różnych dziedzinach nauki.
Proces identyfikacji zaczyna się od analizy konfiguracji elektronowej, która wskazuje, do którego bloku w układzie okresowym należy pierwiastek. Blok ten, oznaczony literami s, p, d lub f, jest związany z powłokami elektronowymi i liczbą elektronów walencyjnych. Te informacje są niezbędne do prawidłowego podania nazwy i symbolu pierwiastka chemicznego, co jest szczególnie ważne w kontekście nauki i przemysłu.
Zrozumienie podstaw konfiguracji elektronowej i jej znaczenia
Konfiguracja elektronowa to sposób, w jaki elektrony są rozmieszczone w atomie. Zrozumienie tego pojęcia jest kluczowe dla chemików, ponieważ wpływa na właściwości chemiczne pierwiastków. Każdy atom ma określoną liczbę elektronów, które zajmują różne powłoki energetyczne. Te powłoki są podzielone na poziomy, które są oznaczane liczbami, a także na podpowłoki, które są oznaczane literami. Dzięki temu możemy określić, jak atom będzie reagował z innymi atomami.
- Konfiguracja elektronowa pozwala na zrozumienie, jakie pierwiastki są ze sobą chemicznie powiązane.
- Pomaga w przewidywaniu reakcji chemicznych i tworzeniu związków chemicznych.
- Znajomość konfiguracji jest niezbędna w pracy z układem okresowym.
Jak zidentyfikować blok pierwiastka na podstawie konfiguracji
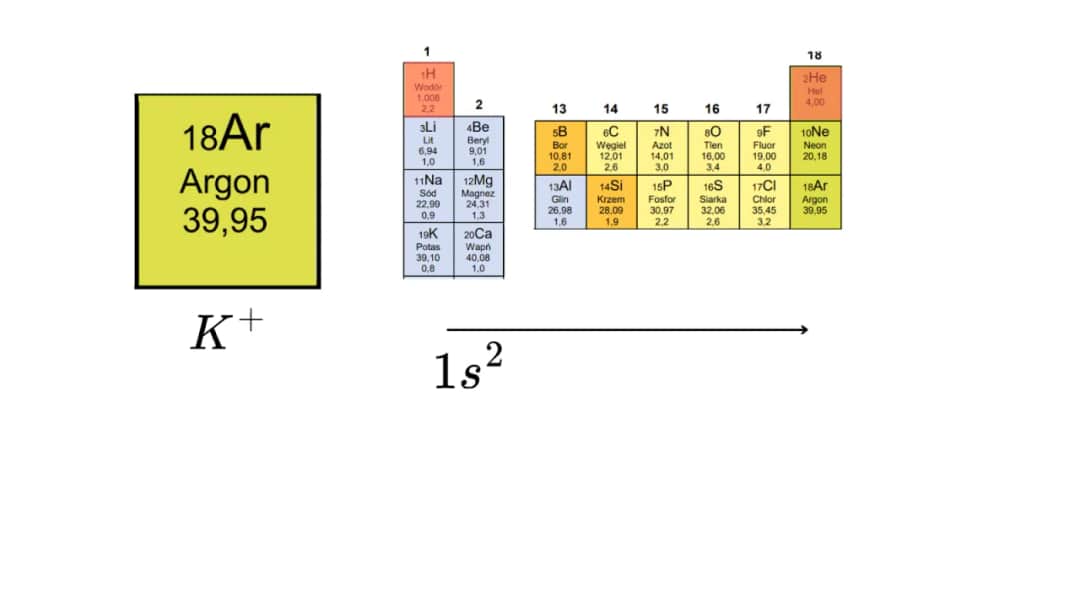
Identyfikacja bloku pierwiastka chemicznego na podstawie jego konfiguracji elektronowej jest kluczowym krokiem w zrozumieniu jego właściwości. W układzie okresowym pierwiastki są podzielone na cztery główne bloki: s, p, d i f. Blok s zawiera pierwiastki, które mają elektrony w powłokach s, natomiast blok p obejmuje te z elektronami w powłokach p. Blok d i f są związane z bardziej złożonymi strukturami elektronowymi, które występują w metalach przejściowych i lantanowcach oraz aktynowcach.
Aby zidentyfikować blok, należy spojrzeć na ostatnią powłokę elektronową pierwiastka. Na przykład, jeśli konfiguracja elektronowa kończy się na s, pierwiastek należy do bloku s. Jeśli kończy się na p, jest to blok p. Ta wiedza jest niezbędna, aby podaj nazwę i symbol pierwiastka chemicznego który oraz zrozumieć, jak różne pierwiastki reagują ze sobą.
Kluczowe informacje o powłokach elektronowych i elektronach walencyjnych
Powłoki elektronowe to warstwy, w których znajdują się elektrony wokół jądra atomowego. Każda powłoka ma swoją maksymalną pojemność, a liczba powłok elektronowych wpływa na właściwości chemiczne pierwiastków. Na przykład, pierwiastki z pełnymi powłokami są zazwyczaj mniej reaktywne. Zrozumienie, ile powłok ma dany atom, pozwala na lepsze przewidywanie jego zachowania w reakcjach chemicznych.
Elektrony walencyjne to te, które znajdują się na zewnętrznej powłoce atomowej. To właśnie te elektrony decydują o tym, jak dany pierwiastek będzie reagował z innymi. Na przykład, pierwiastki z jednym elektronem walencyjnym, jak lit, są bardziej skłonne do oddawania tego elektronu, co czyni je bardziej reaktywnymi. Z kolei pierwiastki z pełnymi powłokami, jak neon, są bardzo stabilne i niechętne do reakcji.
Rola powłok elektronowych w klasyfikacji pierwiastków
Powłoki elektronowe odgrywają kluczową rolę w klasyfikacji pierwiastków w układzie okresowym. Każdy atom ma określoną liczbę powłok, które są rozmieszczone wokół jądra atomowego. Liczba tych powłok wpływa na właściwości chemiczne pierwiastków oraz ich zdolność do tworzenia związków. Na przykład, pierwiastki z pełnymi powłokami są zazwyczaj mniej reaktywne, podczas gdy te z częściowo zapełnionymi powłokami mają tendencję do bardziej intensywnych reakcji chemicznych. Zrozumienie tego aspektu jest niezbędne, aby podaj nazwę i symbol pierwiastka chemicznego który oraz przewidzieć jego zachowanie w różnych reakcjach.
Jak obliczyć liczbę elektronów walencyjnych dla pierwiastków
Obliczanie liczby elektronów walencyjnych jest kluczowe dla zrozumienia reaktywności pierwiastków. Liczba ta odnosi się do elektronów znajdujących się na zewnętrznej powłoce atomowej, które uczestniczą w reakcjach chemicznych. Aby ją obliczyć, należy najpierw znać konfigurację elektronową danego pierwiastka. Następnie, poprzez analizę ostatniej powłoki, można zidentyfikować, ile elektronów walencyjnych dany atom posiada. Warto pamiętać, że pierwiastki w tej samej grupie układu okresowego mają taką samą liczbę elektronów walencyjnych, co wpływa na ich podobne właściwości chemiczne.
Czytaj więcej: Symbol recyklingu: znaczenie strzałek w ochronie środowiska

Przykłady pierwiastków chemicznych i ich konfiguracji elektronowej
Lit, o symbolu Li, to pierwiastek chemiczny, który należy do bloku s. Jego atom ma 2 powłoki elektronowe i jeden elektron walencyjny. Konfiguracja elektronowa litu to 1s² 2s¹, co oznacza, że dwa elektrony znajdują się na pierwszej powłoce, a jeden na drugiej. Lit jest znany ze swojej reaktywności, szczególnie z wodą, co czyni go interesującym pierwiastkiem w chemii.
Neon, z symbolem Ne, jest pierwiastkiem należącym do bloku p. Jego atom posiada 2 powłoki elektronowe oraz 8 elektronów walencyjnych, co czyni go gazem szlachetnym. Konfiguracja elektronowa neonu to 1s² 2s² 2p⁶. Neon jest znany z tego, że jest bardzo stabilny i nie reaguje łatwo z innymi pierwiastkami, co wynika z pełnej powłoki elektronowej.
Glin, oznaczany symbolem Al, należy również do bloku p. Jego atom ma 3 powłoki elektronowe i 3 elektrony walencyjne. Konfiguracja elektronowa glinu to 1s² 2s² 2p⁶ 3s² 3p¹. Glin jest metalem, który jest szeroko stosowany w przemyśle ze względu na swoją lekkość i odporność na korozję.
Analiza litowca: nazwa, symbol i konfiguracja
Lit, o symbolu Li, jest pierwiastkiem chemicznym należącym do bloku s. Jego atom ma 2 powłoki elektronowe oraz 1 elektron walencyjny. Konfiguracja elektronowa litu to 1s² 2s¹, co oznacza, że dwa elektrony są zlokalizowane na pierwszej powłoce, a jeden na drugiej. Lit jest znany ze swojej reaktywności, szczególnie w reakcji z wodą, gdzie tworzy wodorotlenek litu i wydziela wodór. Dzięki swoim właściwościom, lit jest szeroko stosowany w produkcji baterii, szczególnie w akumulatorach litowo-jonowych.
Zrozumienie neonu: jego symbol i właściwości elektronowe
Neon, oznaczany symbolem Ne, jest gazem szlachetnym, który należy do bloku p. Jego atom posiada 2 powłoki elektronowe oraz 8 elektronów walencyjnych, co czyni go bardzo stabilnym. Konfiguracja elektronowa neonu to 1s² 2s² 2p⁶, co oznacza, że wszystkie powłoki są pełne. Neon jest znany z tego, że nie reaguje z innymi pierwiastkami, co wynika z jego pełnej powłoki elektronowej. Jest szeroko stosowany w reklamach świetlnych oraz jako źródło światła w lampach neonowych, nadając im charakterystyczny kolor.
Glin: nazwa, symbol oraz jego miejsce w układzie okresowym
Glin, z symbolem Al, należy do bloku p i ma 3 powłoki elektronowe oraz 3 elektrony walencyjne. Jego konfiguracja elektronowa to 1s² 2s² 2p⁶ 3s² 3p¹. Glin jest metalem, który charakteryzuje się niską gęstością i wysoką odpornością na korozję. Ze względu na swoje właściwości, glin jest szeroko wykorzystywany w przemyśle lotniczym, budowlanym oraz w produkcji opakowań. Jego lekkość oraz wytrzymałość czynią go idealnym materiałem do różnych zastosowań przemysłowych.
Przyszłość zastosowań litu, neonu i glinu w technologii
W miarę jak technologia rozwija się, rola pierwiastków takich jak lit, neon i glin staje się coraz bardziej istotna w różnych dziedzinach. Lit, dzięki swoim właściwościom chemicznym, zyskuje na znaczeniu w produkcji baterii elektrycznych dla pojazdów elektrycznych oraz systemów magazynowania energii. W przyszłości możemy spodziewać się rozwoju nowych technologii, które umożliwią wykorzystanie litu w bardziej efektywny sposób, na przykład poprzez recykling zużytych baterii, co może znacznie zmniejszyć koszty i wpływ na środowisko.
Neon, mimo że jest gazem szlachetnym o ograniczonej reaktywności, ma potencjał w zastosowaniach optoelektronicznych. W miarę postępu w technologii wyświetlaczy i oświetlenia LED, neon może być wykorzystywany w nowych typach lamp i urządzeń, które oferują lepszą efektywność energetyczną oraz dłuższą żywotność. Z kolei glin, dzięki swoim właściwościom mechanicznym, znajduje coraz szersze zastosowanie w przemyśle budowlanym i lotniczym, gdzie innowacyjne metody obróbki mogą prowadzić do tworzenia lżejszych i bardziej wytrzymałych materiałów. Zrozumienie tych trendów pozwoli na lepsze przygotowanie się na przyszłe zmiany w technologii i przemyśle.